摘要
在动物身上,受损身体部位再生的潜力在不同程度上得到了表达。棘皮动物,尤其是海星,以其出色的再生潜力而闻名。不同的是,人类恢复器官系统的能力有限,依赖于有限的干细胞来源。特别是,中枢神经系统再生的潜力极其有限,这解释了为什么缺乏能够克服神经退行性疾病发展和创伤发生的自然机制。因此,了解海星再生的分子和细胞机制有助于开发新的治疗方法。在本研究中,我们通过研究径向神经索(RNC)部分消融后海星中枢神经系统的外部和内部解剖和行为特征、腔胚细胞种群动态和神经元组织结构,来解决海星中枢神经系统再生问题。我们注意到部分RNC的切除产生了一些解剖异常和诱导行为改变(受伤的手臂不能再用来引导海星运动)。这些变化似乎与防御机制和对伤口的保护有关。特别是,组织学显示再生过程中的组织模式类似于在海星和海星臂尖再生中描述的组织模式。流式细胞术结合成像流式细胞术揭示了再生过程后期新的腔胚细胞群。这些和先前表征的腔胚细胞群体的形态型是根据IFC数据描述的。进一步研究这种新的腔胚细胞群可能会提供有关它们参与桡神经索再生的见解。
介绍
再生本质上是一种保守的胚胎后发育过程,修复和替换特定生物体的细胞、组织、器官和身体部位,并且在所有动物门中表达的程度不同(Alvarado和Tsonis 2006;坎迪亚·卡尼瓦利2006)。新细胞在成熟损伤组织的既定环境中发育取决于其组织发生和形态发生的可塑性(Ben Khadra et al. 2017)。再生对棘皮动物的生存至关重要,并为无性生殖提供了必要的程序性补充(Byrne 2020;Candia Carnevali and Burighel 2010)。特别是棘皮动物门的成员(海星、海蛇尾、海胆、海参和羽毛星)都以其再生中枢神经系统以及其他组织或身体部位的杰出潜力而闻名(Allievi et al. 2022;Ben Khadra et al. 2015a, b, 2017,2018;Franco et al. 2012, 2014)。至关重要的是,神经结构是星状棘皮动物中首先再生的,这一特征强调了它们在这些动物再生中的基本调节作用(Ben Khadra et al. 2018)。在成年海星中,新组织再生的细胞机制是来自局部组织的细胞的去分化、转分化和/或迁移(Alvarado和Tsonis 2006;Mashanov et al. 2017;Ferrario et al. 2020)。到目前为止,关于中枢神经系统再生的组织学研究主要是在holothuids中进行的。据文献报道,在这些动物模型中,中枢神经系统损伤后,放射状胶质细胞被激活,进行去分化,产生新的胶质细胞和神经元细胞,完全重建神经形态(Mashanov et al. 2013)。尽管这些放射状胶质细胞已经存在于受伤的海参中枢神经系统中,但在神经再生过程中,这些细胞的增殖会增加(Mashanov和Zueva 2019)。除了神经胶质细胞外,还描述了来自更远地区的迁移细胞的贡献,尽管它们的性质仍有待澄清。据推测,后一过程主要依赖于成体分化细胞的重编程,而不是成体未分化细胞的募集(Mashanov et al. 2017)。值得注意的是,Zheng等人(Zheng et al. 2022)强调,海星幼虫(Patiria miniata)通过重新指定现有神经元来再生其神经系统。具体来说,在该海星的幼虫阶段,受损的神经元表达sox2基因,导致这些细胞重新进入神经发生并形成新的分化神经元。这种调节基因也参与人类神经元再生,在维持胚胎和神经干细胞方面起着关键作用(Pagin et al. 2021)。
海星和海参的神经再生表现出哺乳动物的一些共同特征,如神经索蛋白磷酸化调节(Franco et al. 2012)、与哺乳动物细胞的Yamanaka因子同源的多能因子的存在(Mashanov et al. 2015)、Hox基因同源物的表达(Ben Khadra et al. 2014)、生长因子、神经肽和神经递质的作用(Thorndyke和Candia Carnevali 2001)、以及具有相关作用的相关蛋白质(Franco et al. 2014)。此外,对于神经再生的相似性,相近的分类相似性使Asteroidea成为研究中枢神经系统再生机制的有见地的动物模型,即设想新的治疗方法的发展。
在其他已知参与再生过程的细胞类型中,体腔细胞在海星模型中也起着关键作用,因为它们是第一批被动员到损伤部位的细胞之一,保护内部环境免受外来物质的侵害,愈合伤口,并启动缺失结构的恢复(Pinsino et al. 2007;Smith et al. 2018;Ben Khadra et al. 2017)。不同的种群在这些第一反应阶段调节不同的过程。当海星受伤时,血小板样细胞的作用与人类血小板相似。这些细胞参与止血,迁移到病变部位并形成血块,将内部环境与外部环境分离以防止出血(Ben Khadra等人,2015a, b)。吞噬细胞除了对病原体具有吞噬活性外,还在病变部位形成网络,支持血栓样细胞形成血块(Andrade等人,2021;Ben Khadra et al. 2017)。体腔细胞也可能参与伤口修复,因为在这一过程中它们显示出Hsp70水平的增加,并且该分子诱导在哺乳动物修复阶段释放促炎细胞因子(Ben Khadra et al. 2017;Pinsino et al. 2007)。
为了给海星神经元再生提供新的见解,我们实施了几个实验,如本文所述,只关注研究Marthasterias glacialis (Linnaeus 1758)桡神经索(RNC)创伤性损伤(部分消融)引发的中枢神经系统再生。通过行为学分析和外部解剖学观察,揭示了海星神经损伤对运动和外部形态学的制约作用。采用组织学方法研究损伤神经束再生过程中的细胞组织形态。此外,根据实施的实验方案(Andrade et al. 2021),通过流式细胞术(FC)结合成像流式细胞术(IFC)评估体腔细胞的作用。目的是表征在再生过程中体腔液中循环的体腔细胞群体的动力学。我们的研究结果为神经再生背后的细胞机制提供了新的视角,并提出了参与这一过程的新腔胚细胞群的新作用。
材料与方法
动物收集和养护
成年海星M. glacialis(直径在14至32厘米之间)的标本,先前没有再生迹象,被认为是健康的,是在繁殖季节以外的葡萄牙西海岸(卡斯凯伊斯的埃斯托利尔)的退潮时收集的。这些动物被圈养在“Vasco da Gama”水族馆(Dafundo, Oeiras)的开放式水箱中,水箱中有再循环的海水,温度为15°C,盐度为33‰。他们被随意喂食贻贝。所有标本在整个实验期间保持在相同的条件下,以避免非生物因素引起的变异。
诱导再生
在诱导再生之前,将海星浸泡在4% (w/v)氯化镁海水中麻醉。在个体放松后,通过部分切除靠近手臂尖端约1厘米的桡神经(距离手臂尖端约1厘米的位置)来诱导神经再生。RNC是“外部的”,从口腔一侧很容易到达。紧靠红闪石右边的一臂称为一臂,其后的几臂都是逆时针数的。对于每只动物,在相邻的两臂(1和5)中切除部分神经用于行为实验,仅在1臂中切除神经用于细胞术和组织学实验。因此,对于每只动物,我们考虑了两类手臂:部分切除神经的手臂,即再生神经(RN)和完整神经(NRN)的手臂。
动物位移及外部解剖观察
在神经消融前后,将海星置于装有海水的水箱中央,进行动物位移试验。在2分钟内,记录每只手臂在池中引导动物运动的次数(即作为运动的先导手臂)。每只手臂作为领头手臂使用的次数百分比是通过将该值除以总运动次数得到的。该实验在神经消融前、神经消融后第1、4、8和14天进行。进行t检验以比较两个手臂类别在每个时间点的使用水平。此外,在1小时和第1、2、4和8天,在损伤部位进行外部解剖的视觉检查,并监测几个参数:(a)足部活动或收缩,(b)外部水肿的存在,(c)沿每条手臂的针状体方向不规则,以及(d)手臂在损伤部位的弯曲。
体腔液体收集
在RNC再生过程的初始阶段,通过三个时间点(1天,7天和14天)对腔胚细胞种群和神经形态进行了研究。在每个时间点,从诱导神经再生的两个手臂收集体腔液进行FC和IFC分析,因为预计靠近干预部位的影响更大。体腔液是通过海星手臂尖端表皮的穿孔收集的,以避免内部器官的破坏,使用21毫米的蝴蝶针。在重力作用下,液体被直接输送到猎鹰管中。随后,这些手臂的尖端(大约是整个手臂长度的最后三分之一),包括神经截肢区,用手术刀切开进行组织学分析。将组织固定在Bouin溶液中,每周更新一次,保存在4°C,直到石蜡包埋。
海星臂组织组织学
按照Ben Khadra等人(2015b)所述的标准组织学方案处理bouin固定臂样本。简单地说,在自来水中洗涤几次后,样品在不断增加的乙醇系列中脱水,在二甲苯中清除,在1:1的二甲苯和石蜡溶液中洗涤,然后包埋在纯熔化的石蜡中(56-58℃)。矢状/旁矢状面的教派。用Leitz 1512旋转切片机制备厚度为7 ~ 10 μm的微晶片。两片或三片样品切片放在玻璃载玻片上。那些符合本研究目的的部分(即包括神经间隙或整个神经组织)按照Milligan的三色染色程序进行染色(Milligan 1946)。染色切片用Eukitt®(5%丙烯酸树脂和55%二甲苯安装介质)安装,在配备徕卡EC3相机的Jenaval光学显微镜下观察和拍摄,并使用徕卡应用程序套件LAS EZ软件(版本1.8.0)进行处理。
流式细胞术(FC)
用微移液管重悬CF,并通过40 μm筛网进行初步过滤,去除细胞聚集体和碎片。为了区分活体细胞和细胞碎片,在每个样品中加入0.25 μL的5 μg/mL的DRAQ5 (Invitrogen)。DRAQ5是一种膜渗透性DNA染料,可以检测活细胞(Smith et al. 2004)。样品通过BD FACSAria™III (BD Biosciences)流式细胞仪,使用620/20 BP滤光片和633 nm激光。FC获得的数据随后使用FlowJo软件(版本10.8.1,Becton, Dickinson & Company)进行分析。门控策略在补充图1中描述。
成像流式细胞术(IFC)
使用FC分析所描述的方案处理样品。在葡萄牙里斯本大学“Instituto de Medicina Molecular jo
目录
摘要介绍
材料与方法
结果
讨论
结论
参考文献
作者信息
道德声明
补充信息
搜索
导航
#####
结果
神经消融所致动物移位恢复及外部解剖异常
为了评估损伤后活动能力的恢复情况,我们测定了海星在每个时间点运动中以RN或NRN臂为主导臂的次数百分比。表1描述了RN和NRN武器等级随时间的使用比较的t检验。在诱导再生之前,所有RN或NRN臂都被海星模糊地用作先导臂。神经消融后,两组间先导臂的使用差异有统计学意义(p < 0.05)。我们的数据显示,RNs是使用较少的手臂,特别是在第1天和第4天。在9 PA时,已经观察到RN恢复的迹象,其使用百分比的增量接近于时间点0时的测量值。
在部分切除RNC后,观察到在一些动物中,损伤部位的一些外部解剖异常是明显的:(a)外部水肿,(b)手臂弯曲,(c)每只手臂的针状体方向不规则,(d)足部内缩回。随着时间的推移,对这些不同特征的存在进行了监测。在PA 1小时几乎看不到手臂水肿,但在PA 1天时,50%的RNs已经可见,在PA 2天至PA 8天后,手臂水肿的存在有所减少。神经切除1小时后,手臂局部弯曲也很明显。在PA第1天,所有动物的两个rnn都观察到这一特征,然后直到PA第8天,大多数动物都能看到这一特征。针状体的错位表现出类似的时间模式,出现在PA 1小时,在PA 1和2天突出,并在PA 4天开始恢复阶段。最后,管足在PA 1h时仍然活跃,然后在PA第1天强烈不活跃,并在分析的剩余时间内完全不活跃,直到PA第8天(表2和图1)。这种不活跃与足部的缩回有关。在所有动物的nrn中都没有观察到这些特征。

RNC再生1小时(a和b)、1天(c)、2天(d)和8天(e和f)解剖异常演变的口腔和胎儿视图。RN,再生臂;LB,局部弯曲;MS,针状体错位;RP,缩回的脚;E、水肿
神经索再生的组织形态
未损伤的神经索(对照)的一般解剖结构符合Smith(1937)的描述,与其他海星物种的解剖结构一致(Hyman 1955)。事实上,RNC呈v形结构,沿着每只手臂的中间纵平面,在步行沟内,并在侧面受到两排足部的“保护”。与其他隐针鞘棘皮动物(海胆、海蛇尾和海参)不同,RNC是“外部的”,与环境直接接触(这一因素有利于手术消融)。在RNC上方,在离体方向上,平行于RNC的是下神经窦和径向水管,两者都是体腔衍生的管道(图2a)。如图2b所示,未损伤的RNC组织在两个相邻的平行神经上皮带中,一个较厚的外外神经带和一个较薄的内下神经带,两者被一层薄薄的结缔组织分开。外神经系统进一步分为三层:(1)覆盖细胞表面的不透明且薄的细胞外透明层;(2)体细胞区主要包括上皮支持细胞(胶质细胞)的细胞体和部分神经元的下方;(3)神经堆,这是一个主要由神经原纤维组成的纤维区,混杂着分散的神经元和支持细胞的顶端含有中间细丝束。相反,下神经系统非常薄,很难与覆盖的体腔上皮区分开来,并与下神经窦的液体直接接触。所有样本在第1天的连续矢状面切片显示一个不完整的RNC,有一个间隙,对应于消融区(图2c)。损伤的神经索末端虽然已经被一层细胞体愈合,但仍显示出神经组织结构紊乱的区域,分泌出一层薄薄的透明层(图2e)。在PA第7天,大多数样本的神经不再破裂(图2f);事实上,这个间隙现在被一条非常细的神经填满了(图2g),沿着径向水渠排列。这种再生神经的特点是存在多层细胞体,而神经瘤几乎不可见。在PA第14天,神经细胞比第7天更厚、更有组织,再生的RNC的组织模式与未损伤的RNC相似,尽管厚度通常有所减少(图2h、i和k)。除RNC外,消融后期间其他组织/结构也受到局部影响。从第1天到第14天,神经间隙水平的足部保持缩回(图2c、f和i);外部检查也可以看到这个特性(见上文)。此外,在所有再生样本中,神经下窦和径向水道的局部肥大区域是明显的(图2d)。在术后第14天,体腔衍生通道和相关的血管窦肿胀尤为明显(图2i)。
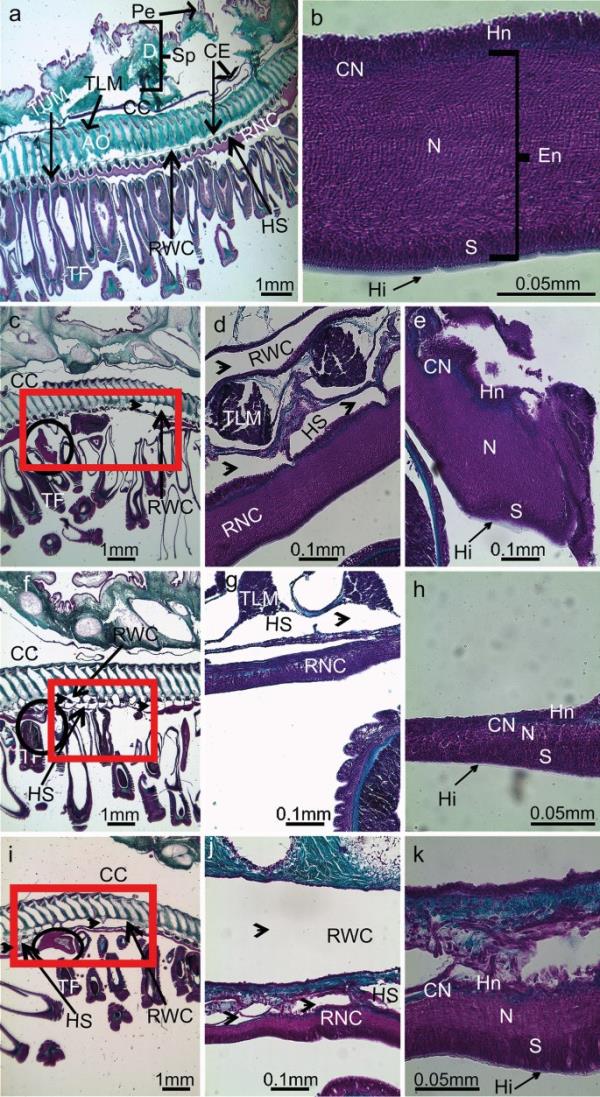
对照条件a和b的海星臂矢状面切片,在第1天的PA c中,体腔管(箭头)肥大d和损伤RNC末端的肿块e,在第7天的PA f-h和第14天的PA i-k中。定位:左侧近端至右侧远端;上界为口侧,下界为口侧。AO,脚侧听骨;Cn,结缔组织;CC:体腔;CE,体腔上皮;D,真皮;恩,ectoneural;Ep,表皮;嗨,透明层;接下来,hyponeural;HS,下神经窦;N,神经纤维网;Pe、pedicellariae;RNC,桡神经束;RWC,径向水道;S,体细胞区(细胞体层);Sp,脊柱;TF,管脚;TLM,横下肌;TUM,横上肌。桡神经束表示:(黑色圆圈)非再生末端的肿块,(红色方块)再生中的神经间隙/组织
腔胚细胞种群的动态
在FC再生RNC过程中,体腔液体循环体腔细胞群体被表征。基于DRAQ5强度和侧散点(SSC-A)值对细胞群体进行表征(见补充信息)。这使我们能够在非再生条件下检测到两个不同的种群(P1和P2),它们具有不同的形态复杂性和荧光特性(图3a),如我们最近发表的文章(Andrade et al. 2021)所述。在神经再生条件下,在PA第1天检测到类似的情况(图3b)。有趣的是,在PA第7天,在一些动物中检测到新的腔胚细胞群,这里称为P3(图3c)。在PA第14天,所有动物(N = 5)体内的P3含量均已较高(图3d)。这种新的细胞人口往往显示中间值P1和P2 DRAQ5公司的细胞,然而显然与侧散射值P1细胞类似,表明相似的形态特征,后者,细胞类型(图3 c和d)。重要的是要注意,检测到细胞外的限制这三个数量显示在图3没有放置在一个足够丰富的情节,因此他们不认为另一个人。
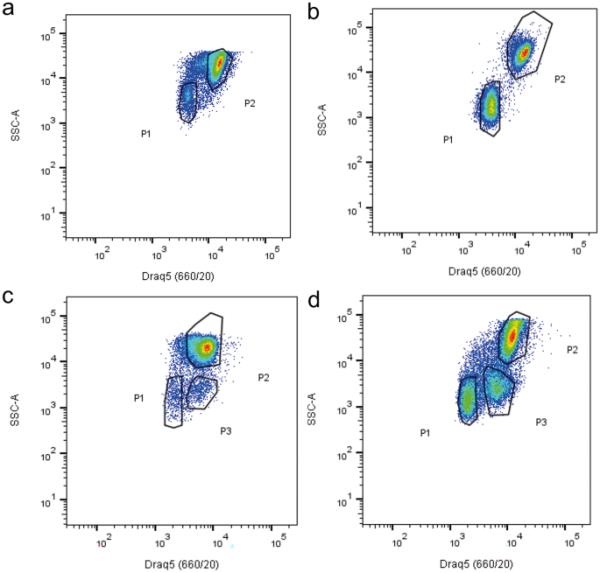
桡神经索(RNC)再生过程中体腔细胞的流式细胞术分析。通过观察对照a、部分神经切除后第1天、第7天和第14天DRAQ5与SSC-A的中位荧光强度来检测循环腔胚细胞。N = 6个对照组,每个时间点5个
还测定了再生和非再生样品中检测到的每个群体的细胞百分比。P1和P2群体的这些值在神经再生过程中没有变化(图4a和b)。在第7天和第14天,与第0天或第1天的测量值相比,新检测到的群体(P3)的细胞数量(图3c)显着增加(p < 0.05)(图4c)。
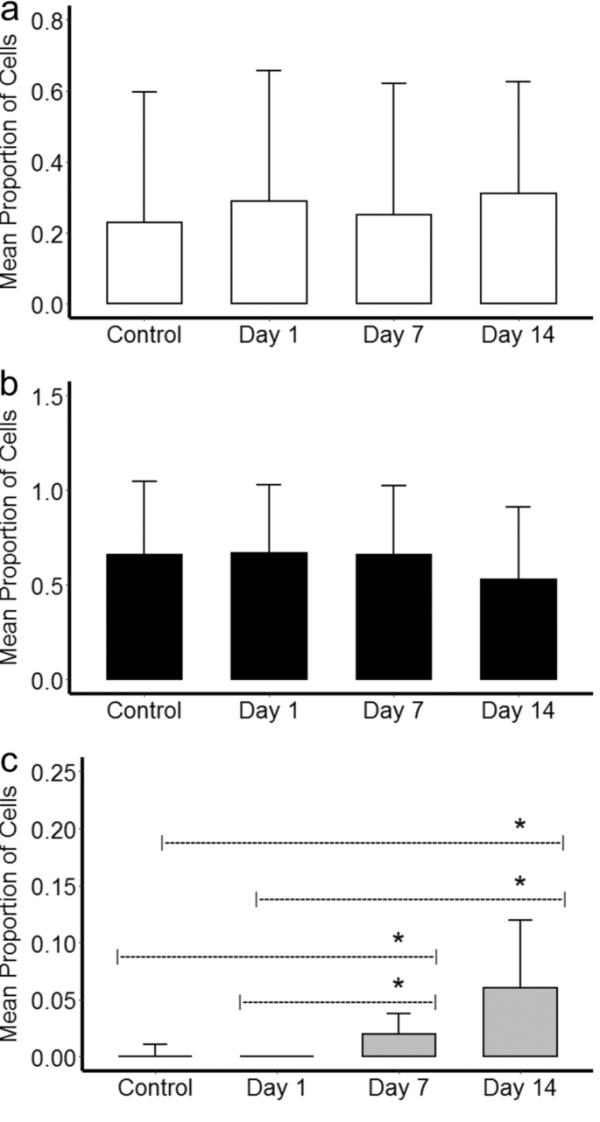
柱状图为对照组和部分桡神经消融后每个时间点(1,7,14天)P1 a, P2 b和P3 c细胞的平均百分比(N = 6个对照组,每个时间点N = 5个标本)。*差异有统计学意义(p < 0.05)
通过IFC表征腔胚细胞群体及其形态型
在RNC再生过程中对循环腔胚细胞进行IFC,以进一步表征新生P3细胞的形态学特征。分析前,在IDEAS软件中根据参数“均方根梯度”(RMS = 40-80)和“宽高比”与亮场(BF)通道细胞面积的关系选择聚焦的单细胞。利用相似的FC选择参数、SSC通道的强度和DRAQ5的强度,可以区分P3群体。该群体的细胞呈圆形/椭圆形,有一些细胞质延伸,显示外部明亮(浅色或深色)外围,内部含有几个深色颗粒(图5a和b)。细胞核被DRAQ5强烈标记(图5c)。与FC结果相匹配,P3细胞显示的DRAQ5强度值介于P1和P2细胞之间,SSC值与P1细胞相似(图5d和e)。根据我们的FC数据,在非再生海星体腔液中检测到的P3事件数量较少(8-11%)(图5d)。在14 PA时(图5e), P3细胞数量明显增加(22-30%)。
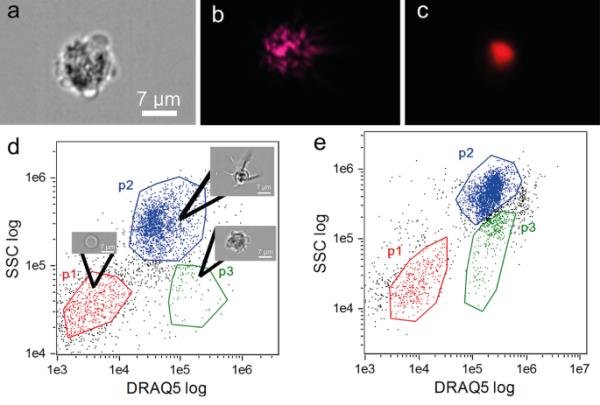
用DRAQ5染色的P3群体的IFC特征。a Bright field, b SSC, c DRAQ5荧光图像。d点图显示非再生条件下SSC与DRAQ5强度的对比。e点图显示部分神经消融后14天的SSC对数和DRAQ5对数强度。图中红色、绿色、蓝色的圆点分别代表P1、P2、P3
为了获得一种有效的方法来标记每种细胞类型,还使用IFC参数对循环腔胚细胞种群及其形态进行了选择。使用人工智能(IA)算法定义更好的区分特征,即IDEAS软件中“引导分析”的向导“特征查找器”,从归属于每个种群的集中单细胞作为训练集开始。表3给出了几个种群及其各自形态的区别参数。根据该算法,通过单元格的面积和高度区分P1和P2。P3细胞与P1细胞在DRAQ5信号强度和BF大小特征上存在差异,与P2细胞在BF大小特征上存在较大差异。先前通过荧光显微镜描述的两种P1形态型(Andrade et al. 2021)也通过IA算法进行了区分。此处,P1S形态表现为较小的核与细胞质之比,细胞质颗粒状,被不间断的亮红色膜包围。P1L型的细胞核占据了大部分的细胞空间,显示出较少的不均匀BF图像。此外,通过IFC检测到第三种P1形态型,并将其命名为P1亮细胞(P1B)。这种形态可以被描述为具有较高的核与细胞质比例,并由明亮的光环勾画轮廓(图6)。对于P2群体,吞噬细胞(花瓣状与丝状形态)在与细胞形状相关的各种BF特征方面有所不同。也可以通过一些与细胞结构(即细胞内部复杂性)相关的BF特征来区分血小板(规则型与大颗粒型)。两种吞噬细胞类型(花瓣状和丝状)都可以通过细胞形状的BF特征进一步从两种血栓细胞形态(多边形和大颗粒状)中分化出来。如Andrade等人(2021)所述,这些分化也通过荧光显微镜完成。

新P1B形态的亮场图像a、SSC b和draq5c信号强度
对P1细胞应用歧视性IFC特征后,通过两步方法可以在IFC点图中定位P1的三种形态型(图7)。首先,通过其最佳歧视性特征选择P1L和P1S细胞形态型(图7a)。然后,添加通过(CH1)中的“调制”和(CH9)中的“对象标准差”参数与其他P1形态区分的P1B细胞(图7b)。
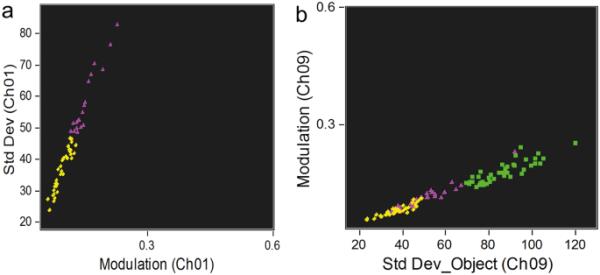
IFC对P1形态型的鉴别。a通过纹理特征之间的关系表示P1L和P1S之间的区别,b表示P1B与P1S和P1L细胞之间的区别。黄钻,P1L;绿色方形,P1B;紫色三角形,P1S
对于P2型,同样可以采用三步法。通过选择“形状比”(CH1)和“物体圆度”(CH1)参数来区分血小板和吞噬细胞。特别是,吞噬细胞和血小板分别通过0-0.6和0.8-1.0的“形状比”和0-10和20-50的“物体圆度”的门范围选择(图8a)。此外,每个吞噬细胞和血小板的两种形态可以通过其最佳的区分特征来选择,如表3所示(图8b和c)。
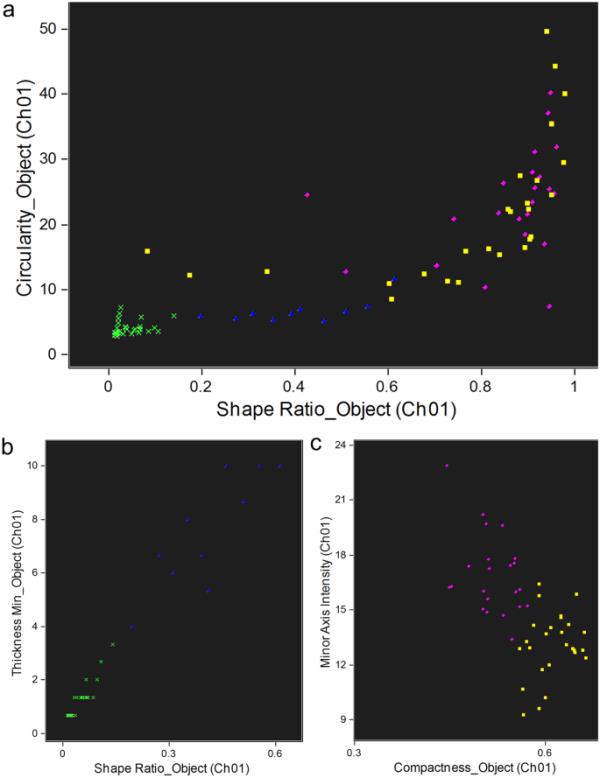
IFC对P2型的鉴别。a吞噬细胞(花瓣状和丝状细胞)与血小板(多边形和大颗粒细胞)分化的点阵图,b花瓣状丝状细胞,c多边形和大颗粒细胞通过细胞形态特征之间的关系。绿色十字,花瓣状;蓝色三角形,线形;黄色方形,颗粒大;紫色的圆,多边形
讨论
神经消融引发海星活动行为的改变,并在再生臂中造成解剖异常/改变
动物行为包括两种不同但互补的机制:先天机制和适应性机制。Migita及其同事(Migita et al. 2005)将适应性行为定义为动物在不符合其目的的情况下灵活改变其固有行为模式的能力。由于海星缺乏自我意识或意识复杂系统,一个自组织的系统,如神经肌肉活动,可能是他们天生行为调节的答案(Kelso 1995)。海星中枢神经系统通过外周神经系统(PNS)的外周运动神经与海星身体的各个部位相连。RNC通过超节神经广泛支配海星手臂的几个效应体,如管足、肌肉、腹膜、表皮和许多可变胶原组织的元素(Mashanov et al. 2016)。以前的文献报道,RNC的某些束具有运动功能,可能专门用于动物(海星)运动时的方向。此外,RNC可能将局部信息传递给五只手臂,以便通过神经延伸产生协调的行为(Dale 1999;Kerkut 1954)。此外,管足的自组织可能有可能改变海星的运动(Migita et al. 2005)。海星选择一只手臂来引导它们的运动,当它们遇到障碍物时,它们可以通过改变领头的手臂来改变自己的行为,或者只是通过帮助原来的手臂来招募邻近的手臂。因此,这种行为可能是由于多层自组织机制,包括管脚的较低自组织(Migita et al. 2005)。
在本研究中,RNC的部分消融触发了海星位移的调整(手臂的选择导致动物运动和足部活动的丧失)和受伤手臂的解剖改变(足部缩回,手臂局部弯曲和外侧针状体错位)。这些变化在再生期的大部分时间里保持不变。假设中枢神经系统控制外周神经支配效应器,RNC组织的部分切除可能导致其功能丧失,因此,可能直接影响足部和针状体的运动,从而间接影响局部手臂弯曲。另一方面,海星臂尖截肢后,第一个应急反应的特点是受伤部位的体壁强烈而迅速的收缩(Ben Khadra et al. 2015a, 2017)。这一过程被观察到与内脏周围体腔(主体腔)肌肉层的部分收缩有关,可能是一种防御反应,以减少体液的流失(Ben Khadra et al. 2017)。此外,观察到收缩将足部拉向伤口的中心区域(Ben Khadra et al. 2015a)。因此,通过外部解剖和组织学切片分析(图1和2)观察到的足部缩回可能与类似的肌肉收缩过程或神经支配的丧失有关。因此,足部的缩回导致它们在PA 1至14天之间不活动,也可能是保护受伤神经的防御机制。在RNC部分切除后,海星在使用RN作为运动的主导臂方面发生了变化,未能使用RN臂而过度使用NRN臂。事实上,当海星的前肢神经处于再生状态时,它对猎物的食欲反应会恶化(Piscopo et al. 2005)。这篇论文的作者声称,这种行为背后的原因是运动功能神经元系统组织的丢失,因为海星在这个神经元系统再生时恢复了食欲反应(Piscopo et al. 2005)。尽管如此,在PA第1天至第9天期间,RN作为牵引臂的丧失可能是足部收缩和不活动的副产品。有趣的是,在PA第9天和PA第14天之间,RN作为领导臂的使用有微弱的增加,这与再生期相吻合。当神经完全再生并显示出与非再生神经组织相似的形态和结构时,可以看到完全恢复。此外,当海星移位并改变方向时,由于右臂足部仅在病变部位失活,因此远离损伤部位的右臂仍沿着前臂的方向运动,而受伤部位不跟随前臂的方向运动。在受伤手臂的末端和近端,这些对比作用导致RN臂尖端弯曲(图1)。尽管,正如Ben Khadra等人(2015a)所见,一种互补机制可能正在起作用,因为海星体壁的强烈收缩也可能与这种解剖异常的产生有因果关系。后者是由于在手臂尖端再生过程中,只有在受伤残端远端,体壁表现出特别强烈的收缩。在海星的棘和针状体上观察到另一种效应,海星的棘和针状体已知具有机械感受性(Garm 2017)。他们观察到的错位(表3和图1)可能是神经组织协调缺陷的可能后果。综上所述,由于中枢神经系统组织部分缺失导致动物解剖结构调整和移位的主要原因可能是其运动行为缺乏连接,也可能是受支配的效应器与体壁收缩之间缺乏功能连接的结果。
伤口区域出现水肿(50%和65%的实验动物在1 - 2pa)可被视为第一紧急反应,通常与损伤相关的组织肿胀并导致液体积聚。这一现象之前在海星截肢后72小时至1周的手臂尖端再生期间被观察到(Ben Khadra et al. 2017)。在手臂尖端再生过程中,水肿是指由成纤维细胞、吞噬细胞、神经细胞、去分化肌细胞组成的肉芽组织的临时区域。未分化的细胞嵌入高度无序的胶原/ECM基质中,该基质位于表皮下方,起到伤口保护作用(Ben Khadra et al. 2017)。然而,最终在我们的组织学检查中没有观察到这一过程的迹象,因为它可能主要与由于液体积聚引起的体腔扩大有关。
组织学揭示了RNC再生过程中手臂组织模式的见解
通过对手臂样本的组织学分析,可以确定受损RNC以及周围组织在神经再生过程中恢复的组织模式。所有棘皮动物,比如海星,都有所谓的中枢神经系统,但没有集中的大脑。该神经系统的特点是在中央椎间盘存在一个环口神经环和五个桡神经索(RNC)沿手臂运行,平行于径向水渠(Ruppert et al. 2004;Mashanov et al. 2016)。RNC由神经元和放射状胶质细胞的聚集组成,与广泛的神经瘤相关(Mashanov et al. 2013)。放射状胶质细胞是神经系统的非神经元细胞,负责神经元的支持和稳态(Ortega和Olivares-Bañuelos 2020)。如前所述,本文描述的RNC具有与其他报道的小行星物种相似的成分、形态和结构(Hymann 1955;Ben Khadra et al. 2015b),其中RNC呈v形形态,其外侧与表皮连续,其主要成分是外神经系统。例如,在Holothuroidea (Mashanov et al. 2013)中报道了相同的组织组织。
海星神经再生的组织学研究主要集中在创伤损伤后的臂尖再生(Moss et al. 1998;Mladenov et al. 1989;Fan et al. 2011;Ben Khadra et al. 2015a, b, 2017)。这一过程通常包括三个主要阶段:(1)修复阶段,以伤口愈合为特征,包括吞噬细胞和血小板样细胞在损伤部位的积累,以保护体内环境,以及神经发生的最初迹象;(2)早期再生阶段,在此期间组织重组和组织再生现象的最初迹象出现;(3)高级再生阶段,以组织修复和再生为特征,形成与成人手臂相同结构的新的小再生手臂(Ben Khadra et al. 2015a, b);Moss et al. 1998)。这种多步骤过程也可以在部分消融后RNC的再生中看到(Ben Khadra et al. 2015a)。我们的样品遵循这个过程。事实上,与海星Echinaster sepositus的观察结果相比(Ben Khadra et al. 2015a),神经末端在PA 1天后愈合。这种愈合的特点是RNC伤口边缘的再上皮化,这是由细胞进行的,至少部分来自附近的神经残端,尽管不能排除更远的迁移/循环元素的贡献。因此,在棘皮动物中,修复阶段的时间显然是维持的,无论分析的物种是什么。此外,残肢愈合过程中涉及的结构/组织似乎是相同的(Ben Khadra et al. 2018)。在第二阶段,在第7天,神经区开始分化。这种模式再次与脓杆菌的模式完全相似;在后者中,支持的放射状胶质细胞是新神经组织中形成的第一个组成部分,在那里它们重建了随后神经元再生所需的结构网络(Ben Khadra et al. 2015b)。进一步的相似之处可以在海参Holothuria glaberrima部分神经消融后RNC的再生中发现(Miguel-Ruiz et al. 2009)。一个有趣的方面是,细胞增殖并不是全息图RNC再生的主要机制。此外,有证据表明,RNC再生并不依赖于驻留的未分化/干细胞(Mashanov et al. 2014)。相反,新神经细胞形成背后的机制可能也发生在附近放射状胶质细胞的去分化和可能从神经上皮较深区域迁移到该区域的其他细胞的募集(Mashanov等,2017;Mashanov and Zueva 2019)。因此,放射状胶质细胞是新神经元元素和新胶质细胞的来源,所有这些都有助于神经组织的再生(Mashanov和Zueva 2019)。最后一个阶段,在第14天,对应于新生组织的生长和终末分化,直到达到与非再生组织相同的大小和结构组织。
在RNC再生过程中,通过FC检测到新的腔胚细胞群
除了神经组织本身的恢复,正如Holothuroidea (Mashanov et al. 2017)所证明的那样,受损RNC周围的其他组织的参与是需要考虑的另一个重要方面。事实上,神经消融的创伤事件和随后的组织再生和重塑预计会引起局部,但也可能是全身的炎症/免疫反应。对于所有体腔和体腔衍生的腔体来说尤其如此,在这些腔体中,棘皮动物的典型免疫细胞,即体腔细胞,正常地循环。正如预期的那样,在整个再生过程中,神经下窦(直接面向RNC)和径向水管都出现了局部肥大。类似地,在附近的血管窦中观察到中度肥大,一个非体腔系统的腔隙也参与免疫功能,其中也含有体腔细胞。其他作者认为,这一现象可能是由于过度使用体腔/体腔来源的管道来运输分子和来自邻近组织的免疫细胞或其他迁移细胞(Hernroth et al. 2010;Guatelli et al. 2022)。我们在RNC再生过程中发现并在下面讨论的腔胚细胞组成的变化完全符合这一观点。
细胞类型,最重要的是,在棘皮动物体腔液中循环的细胞的起源一直是一个长期讨论的问题。最近,我们的研究(Andrade et al. 2021)利用流式细胞术(FC)和成像相结合的方法,使我们能够详细地表征海星中两个体腔细胞群,称为P1和P2。这两个细胞群在丰度、细胞大小、细胞形态复杂性和荧光DNA插入物的结合方面存在很大差异。与P1细胞相比,P2细胞显示出更高的侧散射(SSC)和正向散射(FSC)值,这可能是由于其更复杂/结构化的表面和更丰富的内部细胞结构。此外,P2细胞含有大约两倍的DRAQ5,并且比P1细胞更丰富,占总循环体腔细胞的60-70%。
在本研究中也发现了这两种具有相同FC特征的腔胚细胞群。这些群体在所有实验组中都以相似的比例存在,无论是在控制条件下还是在神经再生样本中(在所有时间点)。在之前的分析中(Andrade et al. 2021),检测到单倍体和低有丝分裂活性P1细胞群的两种形态。一个具有较少的异质核和较高的核与细胞质比被假设为更成熟的形态型的非分化形式。后者具有较低的核与细胞质的比例,并含有大量的颗粒质。另一个种群,P2,在同一份出版物中也有描述。其主要形态有两种:一种与吞噬细胞相似,分为花瓣状细胞和丝状细胞;另一种称为血小板样,由规则(多边形)和大颗粒细胞组成。此外,仅在荧光显微镜下观察到另外两种P2形态。在本研究中,在PA第7天至14天之间,在循环体腔细胞中检测到一个新的种群,这里称为P3,并通过使用FC和IFC方法进一步表征。P3细胞与P1细胞具有相似的内部复杂性,并表现出介于P1和P2细胞之间的DRAQ5掺入值。
体腔细胞的起源尚不清楚。轴向器官(Leclerc and Bajelan 1992)、Tiedemann的小体(Kaneshiro and Karp 1980)、血管器官(Ferguson 1966)和体腔上皮(Guatelli et al. 2022;Sharlaimova et al. 2021;Bosshe和Jangoux 1976)被认为是海星中所谓的造血组织的候选者。尽管如此,最后一种组织是目前最被接受的执行上述功能的候选组织。这里一个特别相关的问题是了解循环体腔细胞的来源及其组成群体。最初的显微镜分析显示,体腔上皮细胞与循环体腔细胞具有相似的超微结构特征(Holm et al. 2008;Gorshkov et al. 2009;Sharlaimova et al. 2010),尤其是血小板样细胞(Guatelli et al. 2022)。此外,蛋白质组学分析显示,冰草体腔上皮和循环体腔细胞中存在一些共同的蛋白质,包括与细胞运动相关的蛋白质,这可能表明细胞从体腔上皮向体腔腔移动的迁移行为。与再生过程最相关的事实是,组织学表明,在臂尖再生过程中,体腔上皮细胞经历了部分去分化和随后的上皮-间质转化。这将表明体腔上皮来源的细胞直接参与再生结构的重建。然而,无论是在非再生条件下还是在再生条件下,从未观察到自由游离的体腔上皮细胞从体腔上皮的顶端直接向体腔腔释放(Guatelli et al. 2022)。另外,如上所述,体腔上皮可能通过免疫因子提供免疫应答,参与体腔和体腔源性管道的肥大。在这种情况下,P3群体的生理作用虽然在再生过程中明显相关,但需要确定。
下载原文档:https://link.springer.com/content/pdf/10.1007/s00441-023-03818-x.pdf
为您推荐:
- 学生们在900英尺高的山上的恐惧:科技和科学日报播客 2025-05-06
- 格雷文伯奇为俱乐部打进首球,帮助利物浦重回胜利之路 2025-05-06
- 如何在家制作这只强大的机械手 2025-05-06
- 雅各布斯在洛杉矶突袭者队以2比0击败皮尔斯·文森,以16比12击败喷气机队 2025-05-06
- 布莱顿在落后两球的情况下逆转战平马赛 2025-05-06
- 农业部、世界粮食计划署启动了两个项目来解决粮食浪费问题:约旦 2025-05-06


